CEREZO
(Los avisos proceden de las distintas Comunidades Autónomas desde las que se emiten, por lo que las fechas de desarrollo de las distintas plagas y enfermedades de las que se informa han de adaptarse a cada realidad autonómica)
PODREDUMBRE PARDA O MONILIA (Monilia laxa (Ehrenb.) Sacc. y Monilia fructigena Pers)
Monilia laxa (Ehrenb.) Sacc. y Monilinia laxa (Aderhold et Ruhl.) Honey ex Whetzel son el anamorfo –orden Hyphales- y teleomorofo –Helotiales–, respectivamente, de un hongo capaz de provocar enfermedades en frutales de hueso, aislándose de flores y madera. Monilia fructigena Pers. y Monilinia fructigena (Aderhold et Ruhl.) Honey ex Whetzel son las formas asexuada –orden Hyphales– y sexuada –Helotiales– de un hongo que puede producir enfermedades en melocotonero, albaricoquero, ciruelo y cerezo, encontrándose preferentemente en frutos.
Estos hongos desarrollan, sobre las distintas especies de frutales de hueso, enfermedades con síntomas similares, razón por la que, desde un punto de vista práctico, se pueden considerar una sola enfermedad denominada el Momificado de los frutales de hueso. Las flores sufren un marchitamiento general que, a simple vista, pudiera parecer que los ovarios están maduros y se encuentran rodeados de despojos florales. Las ramas pueden resultar afectadas a partir de un ramo floral infectado, marchitándose toda la rama desde ahí hasta el extremo. En los tejidos infectados se observan las fructificaciones del hongo con aspecto de almohadillas o cojincillos grisáceos y, cuando aparecen sobre frutos, suelen distribuirse concéntricamente. Los frutos afectados reducen su volumen y se momifican, de donde le viene el nombre a la enfermedad. También es frecuente la aparición de exudaciones gomosas en las ramas enfermas.
 |
|
Marchitamiento floral indicativo de la presencia de la enfermedad. Autor del dibujo: © Diego Del Moral Martínez (Del Moral-De la Vega et al., 2007) |
Estos hongos pasan el invierno entre las resquebrajaduras de la madera, yemas y frutos momificados de árboles que estuvieron enfermos en la campaña anterior. Al acercarse la primavera recuperan su actividad, y el micelio y las esporas producidas invaden los órganos recién formados. El desarrollo de la enfermedad se produce cuando la brotación coincide con continuos días de lluvia o bruma y temperaturas frescas por encima de 10ºC. En plantaciones con un nivel importante de órganos afectados por la enfermedad, en la primera parte de la primavera, es frecuente que se produzcan infecciones de frutos a partir del envero, manifestándose los síntomas en la recolección o incluso en el almacén.
Terapéutica:
Los tratamientos para controlar la enfermedad en flores y madera parecen ser más eficaces si se realizan entre los estados fenológicos D y H, y en el envero si se quiere evitar en frutos. En el otoño, con el 50 y el 100% de hojas caídas, es recomendable realizar sendos tratamientos con algún producto cúprico.
CRIBADO (Stigmina carpophila (Lév.) M.B. Ellis (syn. Wilsonomyces carpophilus (Lév.) Adaskaveg, Ogawa et Burler, and Coryneum beijerinckii Oud.))
Stigmina carpophila (Lév.) M.B. Ellis es un micromiceto, perteneciente al orden de los capnodiales, capaz de desarrollar enfermedades en frutales de hueso, entre los que se encuentra el cerezo.
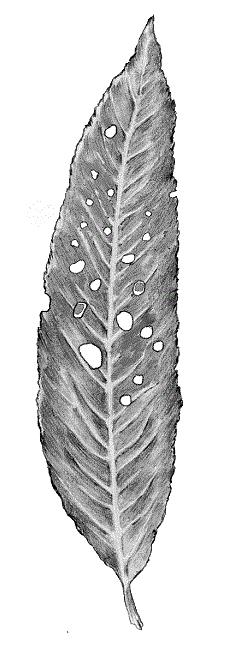
Las características que más claramente evidencian la presencia del hongo son unos agujeros en las hojas, de tal manera constituidos que, por su tamaño y distribución, parece como si las hojas hubiesen sufrido un tiro de escopeta o perdigonada. A veces aparecen en ramas y frutos unas manchas violáceas con exudaciones gomosas.
 |
|
Hoja con numerosas perforaciones a consecuencia del desarrollo de la enfermedad. Autor del dibujo: © Diego Del Moral Martínez (Del Moral-De la Vega et al., 2007) |
El hongo se perpetúa en las hojas enfermas y caídas al suelo y, principalmente, en las lesiones que se producen en la madera. A partir de la brotación, cuando se producen lluvias continuadas y temperaturas por encima de 15ºC, el hongo se activa y propaga, desarrollándose la enfermedad.
Terapéutica:
Para evitar la aparición de esta enfermedad es recomendable tener protegida a la vegetación entre los estados fenológicos D y H, continuando dicha protección durante un mes más si durante este periodo predominan días de lluvia. En el otoño, cuando el 50% y el 100% de las hojas hayan caído es conveniente dar sendos tratamientos, siendo muy eficaces, en estos momentos, los derivados cúpricos.
MOSCA DE LA CEREZA (Rhagoletis cerasi L.
Rhagoletis cerasi L. (Mosca de la cereza) desarrolla su parasitismo con bastante especificidad sobre cerezas.
 |
|
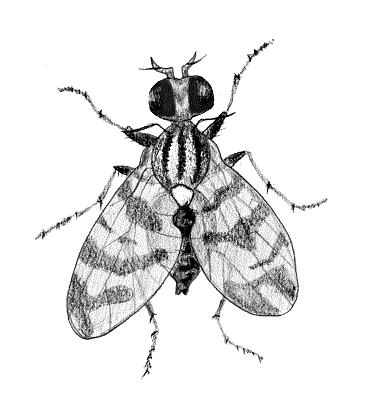
El insecto adulto, de 4mm aprox. de longitud, tiene escudete marfileño y cuatro bandas en las alas. Autor del dibujo: © José Del Moral Martínez (Del Moral-De la Vega et al., 2007) |
El desarrollo del insecto en la pulpa de la fruta parasitada provoca una podredumbre húmeda a consecuencia del desarrollo de microorganismos acompañantes de la mosca. Esta podredumbre se manifiesta al exterior por una mancha circular de color pardo, blanda y húmeda. En la masa de pulpa correspondiente a la mancha externa se aprecian numerosos “gusanos” diminutos, blancos y ápodos, que corresponden a las larvas de la mosca.
Inverna en forma de pupa en el suelo. En primavera, cuando las temperaturas son ya elevadas se transforma en adulto, y la hembra fecundada va visitando los frutos y clavando en ellos el oviscapto para depositar la puesta. El desarrollo larvario se realiza en el interior del fruto. Completado su desarrollo sale a la superficie y se deja caer al suelo, donde se entierra para transformarse en pupa. Los adultos emergentes vuelven a parasitar a los frutos o se trasladan a otros de distintas especies, pudiendo tener hasta 8 generaciones al año entre las diversas especies parasitadas. Las últimas larvas evolucionan a pupa en el suelo e invernan como tal.
Terapéutica:
Para evitar la formación de plagas de este insecto es necesario observar los frutos más maduros de la plantación desde 40 días antes de la recolección, protegiendo los frutos con un específico a partir de la aparición de los primeros daños.
DROSOPHILA DE ALAS MANCHADAS (Drosophila suzukii Matsumura)
(Copia reducida y adaptada de la traducción de la ficha de datos de Claudio Loriatti Invasive Species Compendium. Wallingford, UK: CAB International, 2018, donde la bibliografía propia del documento se suprime para facilitar la lectura)
La mosca de la fruta D. suzukii es una plaga de cultivos frutales y es una amenaza económica grave para la fruta suave de verano. Una plaga polífaga, infesta una amplia gama de cultivos frutales, incluida la uva, así como un número cada vez mayor de frutos silvestres. D. suzukii es una plaga económicamente dañina porque las hembras son capaces de infestar las frutas de piel fina antes de la cosecha y las larvas destruyen la pulpa de la fruta al alimentarse. La especie es endémica en Asia. Primero fue registrado como invasivo en Hawaii en 1980 y luego simultáneamente en California y en Europa en 2008. Desde 2008 se ha extendido rápidamente a través de las regiones templadas de América del Norte y Europa, debido al comercio global y la falta inicial de regulación sobre la propagación de cualquier Drosophila.
Esta especie tiene una alta tasa de reproducción y corto tiempo de generación; D. suzukii teóricamente puede tener hasta 13 generaciones por año, lo que puede contribuir a una rápida propagación, dados los huéspedes adecuados disponibles. D. suzukii figura en la lista de alertas de la EPPO.
Los adultos de D. suzukii miden 2-3 mm de largo con ojos rojos, un tórax marrón pálido o marrón amarillento y franjas negras transversales en el abdomen. Las antenas son cortas y rechonchas con arista ramificadas. El dimorfismo sexual es evidente: los machos muestran una mancha oscura en el borde superior principal de cada ala y las hembras son más grandes que los machos y poseen un gran ovipositor aserrado.
Los huevos son ovales (el eje menor es de 0’2 mm), de color blanco lechoso, con dos filamentos (aeropyle o spiracle) en un extremo, de 0.4 a 0.6 mm de largo.
Las larvas similares a gusanos son blancas con órganos internos visibles y piezas bucales negras. Crecen a lo largo de tres etapas larvarias y cuando crecen por completo pueden alcanzar una longitud de 5’5 mm y una anchura de 0’8 mm.
Las pupas son fusiformes, de color marrón rojizo y tienen dos tallos con pequeñas proyecciones en forma de dedo, de 3’5 mm de largo y 2 mm de ancho.
D. suzukii está predispuesto a infestarse y desarrollarse en frutos maduros no dañados. Las frutas se vuelven susceptibles a D. suzukii cuando comienzan a cambiar de color, lo que coincide con pieles suaves y niveles de azúcar más altos. Existen diferencias en la susceptibilidad de la fruta dentro de las especies y entre las variedades dentro de la misma especie de fruta. La fuerza de penetración de la fruta es una medida potencial de la susceptibilidad del huésped, pero el atractivo del huésped probablemente dependerá de factores adicionales, como el contenido de azúcar soluble. Si no hay fruta adecuada disponible, entonces D. suzukii atacará la fruta dañada o deteriorada. También pueden ser atacados los frutos caídos sin fines comerciales o las frutas dañadas de los siguientes hospederos: Prunus persica , Malus pumila var. domestica, Prunus triflora, Prunus armeniaca, Pyrus pyrifolia, Pyrus sinensis, Eriobotrya japonica, Lycopersicum esculentum y Rubus microphyllus , así como higos dañados aún en el árbol ( Ficus carica).
Las larvas de D. suzukii causan daño al alimentarse de la pulpa dentro de las frutas y bayas. La fruta infestada comienza a colapsar alrededor del sitio de alimentación causando una depresión o mancha visible en la fruta. La cicatriz de oviposición expone la fruta a un ataque secundario por patógenos y otros insectos, que pueden causar.
Las moscas emergen en primavera, pero algunos adultos pueden estar activos durante los días cálidos de invierno. Los huevos se ponen en frutas maduras y el número de huevos por fruto varía de uno a varios, repartidos por la fruta. La selección del hospedador de D. suzukii bajo condiciones de campo puede diferir entre especies y entre variedades dentro de una especie, y las observaciones de laboratorio sugieren que la firmeza de la fruta puede ser uno de los impulsores de esta selección. La puesta de huevos dura de 10 a 65 días con hasta 21 huevos puestos por día. Cada hembra puede poner 195 huevos durante su vida. Los huevos eclosionan en 1-3 días, las larvas maduran en 3-13 días y la mayoría de ellas pupan en la fruta, pero algunas caen y se arrastran hacia el suelo. El período de las pupas dura entre 4 y 43 días. La tasa intrínseca mínima, óptima y máxima de aumento natural se estimó en 13’4, 21’0 y 29.4 ° C.
El apareamiento de nuevos adultos puede ocurrir en cualquier momento del día, pero se puede observar más a menudo durante el día cuando la temperatura es relativamente alta. Los machos siempre están activos, pero las hembras son pasivas. Las hembras ovipositan después del apareamiento y repiten el apareamiento días después. La oviposición generalmente ocurre de abril a noviembre.
El ciclo de vida desde la eclosión del huevo hasta la emergencia del adulto oscila entre 9-10 días y 21-25 días a 25 ° C y 15 ° C, respectivamente. Recientes observaciones de laboratorio registraron el desarrollo desde el huevo hasta la puesta de huevos de las hembras desde aproximadamente una semana a 12-15 días a 21.1 ° C y a 18.3 ° C, respectivamente.
La vida útil de los adultos es de 20-56 días, pero algunos adultos que invernan vivieron durante más de 200 días.
El desarrollo de D. suzukii se fomenta mediante el cultivo extensivo de cultivos susceptibles (principalmente frutos rojos y cerezas), distribución de tierras cultivadas a diferentes altitudes (ofreciendo una maduración de la fruta diferenciada y extendida), la proximidad de los bosques y las áreas no cultivadas o marginales con frutos silvestres susceptibles. D. suzukii parece tener relaciones importantes con bosques, donde puede encontrar un microclima adecuado y hospedarse en plantas durante todo el año.
El establecimiento de D. suzukii en regiones más septentrionales, donde hay inviernos rigurosos, probablemente dependa de la presencia de sitios favorables de hibernación que generalmente están asociados con el hábitat humano.
La presencia de D. suzukii adulto en el campo puede controlarse mediante el uso de trampas cebadas con diferentes atrayentes. Cualquier recipiente de plástico de 250-750 ml con una tapa ajustada se puede utilizar como una trampa. Se deben taladrar agujeros de 0’5 - 1 mm de diámetro en el lado para permitir el ingreso de las moscas.
Una variedad de prototipos de trampas hechas por investigadores y trampas comerciales están disponibles para monitorear D. suzukii adulto. El número de capturas aumentó a medida que aumentaba el área de entrada de las trampas, pero el tamaño pequeño de los agujeros ralentizaba la evaporación y aumentaba la selectividad contra los insectos más grandes. Las trampas rojas, amarillas y negras eran preferibles sobre claras o blancas, pero había una interacción entre el color de la trampa y el tipo de cultivo. El color de la trampa no tuvo efecto sobre la selectividad hacia otras Drosophilas. Los bioensayos de laboratorio descubrieron que las moscas se veían atraídas por los colores oscuros, que iban del rojo al negro, y que el uso de tres tiras alternas rojas, negras y rojas aumentaba significativamente el número de moscas capturadas. El cebo es necesario para atraer a las moscas a la trampa.
El vinagre de sidra de manzana fue uno de los primeros cebos utilizados porque fue efectivo y práctico de usar. Este señuelo parece haberse mejorado recientemente al agregar vino y vino y azúcar.
La respuesta de la mosca a la combinación de vinagre y vino fue mayor que la respuesta al ácido acético o la combinación de ácido acético y etanol, que son los principales componentes químicos volátiles del vinagre y el vino, respectivamente. Este hallazgo indica que otras sustancias químicas volátiles emitidas por el vinagre y el vino, además del ácido acético y el etanol, también pueden ser atractivas para el macho y la hembra de D. suzukii. Una pequeña gota de jabón para platos añadida al cebo líquido como surfactante, o la colocación de una tarjeta adhesiva dentro de la trampa, da como resultado más capturas de moscas.
Terapeútica:
Las medidas de saneamiento incluyen la eliminación y destrucción de fruta infestada y cualquier fruta madura, demasiado madura y podrida en el sitio del cultivo que podría servir como huésped. Se están realizando investigaciones para evaluar la solarización, el enterramiento, el ensacado, el aplastamiento y la pulverización de fruta infestada para desalentar la colonización de D. suzukii.
Una mosquitera con malla de 0,98-1,0 mm previene el daño de la fruta de D. suzukii en el arándano. La protección física de los cultivos mediante el uso de redes antiinsectos se encuentra bajo evaluación experimental y parece ser una alternativa prometedora de estrategias de control para su uso en el futuro cercano.
Los primeros experimentos de control biológico probaron la eficacia de Phaenopria spp. (Hymenoptera: Diapriidae) en condiciones de laboratorio, pero los resultados fueron insatisfactorios.
Se están llevando a cabo estudios para determinar la presencia actual de agentes de control biológico de parasitoides autóctonos y su eficacia para controlar D. suzukii tanto en América del Norte como en Europa por diferentes grupos de investigación. En condiciones de laboratorio, varios parasitoides naturales de Drosophilas en Francia pudieron parasitar exitosamente a D.suzukii. Estos incluyeron dos parasitoides larvales, Leptopilina heterotoma y Leptopilina boulardi y dos parasitoides pupales, Pachycrepoideus vindemiae (Hymenoptera: Pteromalidae) yTrichopria drosophilae(Hymenoptera: Diapriidae). Ambos parasitoides de Leptopilina mostraron altas tasas de parasitismo en D. suzukii , pero debido a la fuerte respuesta inmune de las larvas hospedadoras, no dieron lugar a una avispa adulta.
El ectoparassitoide pupal P. vindemiae también se ha encontrado en asociación con D. suzukii en huertos y viñedos, tanto en EE. UU. como en Europa.
Los depredadores de D. suzukii incluyen varias especies del género de chinches Orius , un depredador generalista. Los estudios preliminares de laboratorio con O. insidiosus , O. laevigatus y O. maiusculus indicaron que pueden alimentarse de larvas de D. suzukii que infestan los arándanos.
Las cepas de la bacteria endosimbiótica Wolbachia asociadas con las poblaciones de D. suzukii se han recogido tanto en los Estados Unidos como en lo que sugieren la posibilidad de controlar D. suzukii en función del uso de patógenos.
Los esfuerzos de control actuales para D. suzukii dependen en gran medida del uso de insecticidas. La gama de insecticidas disponibles para su uso en D. suzukii incluye espinosinas, organofosforados, piretroides y neonicotinoides. Sin embargo, los ingredientes activos no son muy persistentes. Además, la rápida generación de renovación de D. suzukii requiere muchas intervenciones químicas en la etapa de maduración, lo que puede aumentar el riesgo de residuos en las frutas, promover la resistencia a los insectos y afectar negativamente a los polinizadores y otras especies beneficiosas.
TRATAMIENTOS QUÍMICOS/BIOLÓGICOS:
Los productos fitosanitarios a aplicar pueden consultarse en el Registro de Productos Fitosanitarios disponible en la web del Ministerio de Agricultura y Pesca, Alimentación y Medio Ambiente del Gobierno de España (https://www.mapa.gob.es/es/agricultura/temas/sanidad-vegetal/productos-fitosanitarios/registro-productos/) siempre teniendo en cuenta el aviso que el propio Organismo Oficial hace constar:
“La información sobre productos fitosanitarios y empresas fabricantes contenida en esta página tiene carácter meramente informativo. La Subdirección General de Sanidad e Higiene Vegetal y Forestal realiza los máximos esfuerzos para evitar cualquier error en los contenidos que pudieran aparecer, pero no garantiza la exactitud ni la puesta al día de la información, ni asume ninguna responsabilidad al respecto.
Para una información actualizada puede contactarse a través del correo electrónico Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.”
BIBLIOGRAFÍA:
Del Moral-De la Vega, J., Del Moral-Martínez, D., Del Moral, J. & Del Moral-Martínez, J. (2007) La Sanidad de los Vegetales Cultivados: Guía para la identificación de plagas y enfermedades y su control mediante fitosanitarios. Editorial Caja Rural de Extremadura-Albayana.
García, M. (1999). Plagas, enfermedades y fisiopatías del cultivo de la alcachofa en la Comunidad Valenciana. Consellería de Agricultura, Pesca y Alimentación. Dirección General de Innovación Agraria y Ganadera. Valencia, España.
Melgarejo Nárdiz, P., García-Jiménez, J., Jordá Gutiérrez, M. C., López González, M. M., Andrés Yebes, M. F., & Duran-Vila, N. (2010). Patógenos de plantas descritos en España. Editorial Ministerio de Medio Ambiente y Medio Rural y Marino.
WEBGRAFÍA:
Área de Agricultura, Ganadería y Pesca. Servicio Técnico de Agricultura y Desarrollo Rural del Cabildo de Tenerife (2015-2022). Avisos fitosanitarios. Santa Cruz de Tenerife, España: AgroCabildo. Recuperado de http://www.agrocabildo.org/avisos_otros.asp
Comunidad Autónoma de la Región de Murcia (2011-2022) Estado Sanitario. Murcia, España: Región de Murcia. Recuperado de http://www.carm.es/web/pagina?IDCONTENIDO=1226&RASTRO=c212$m1230&IDTIPO=100
Consejería de Agricultura, Pesca y Desarrollo Rural de la Junta de Andalucía (2017-2022). Red de Alerta e Información Fitosanitaria de Andalucía. Sevilla, España: Junta de Andalucía. Recuperado de https://www.juntadeandalucia.es/agriculturapescaydesarrollorural/raif/
Conselleria de Agricultura, Medio Ambiente, Cambio Climático y Desarrollo Rural de la Generalitat Valenciana (2015-2022) Boletín de avisos. Valencia, España: Conselleria de Agricultura, Medio Ambiente, Cambio Climático y Desarrollo Rural de la Generalitat Valenciana. Recuperado de http://www.agroambient.gva.es/boletin-de-avisos
Deputación de Pontevedra (2018-2022) Estación Fitopatolóxica Areeiro. Información Fitosanitaria. Recuperado de https://areeiro.depo.gal/avisos-fitosanitarios-2022.
Dirección General de Análisis y Planificación de la Junta de Castilla y León. (2018-2022) Boletines Fitosanitarios. Valladolid, España: Junta de Castilla y León. Recuperado de https://plagas.itacyl.es/alertas
Generalitat de Catalunya (2018-2022) Avisos fitosanitaris. Barcelona, España: gencat.cat - Informació, tràmits i serveis de la Generalitat de Catalunya. Recuperado de http://agricultura.gencat.cat/ca/ambits/agricultura/dar_sanitat_vegetal_nou/avisos-fitosanitaris/
Gobierno de Aragón (2018-2022) Boletín Fitosanitario de Avisos e Informaciones. Zaragoza, España: Gobierno de Aragón. Recuperado de https://www.aragon.es/-/boletin-fitosanitario-de-avisos-e-informaciones
Gobierno de Cantabria (2018-2022) Plagas. Santander, España: Gobierno de Cantabria. Recuperado de http://www.cantabria.es/web/direccion-general-desarrollo-rural/plagas
Gobierno de La Rioja (2016-2022) Boletín de Avisos Fitosanitarios. Logroño, España: Larioja. Recuperado de https://www.larioja.org/agricultura/es/publicaciones-agricultura/boletin-avisos-fitosanitarios-2022
Gobierno del Principado de Asturias (2006-2022) Plagas y enfermedades vegetales. Oviedo, España: Gobierno del Principado de Asturias. Recuperado de https://www.asturias.es/buscador?p_p_id=pa_webasturias_search_web_portlet_full_SearchWebasturiasWebPortlet&p_p_lifecycle=0&p_p_state=normal&p_p_mode=view&_pa_webasturias_search_web_portlet_full_SearchWebasturiasWebPortlet_groupId=217090&_pa_webasturias_search_web_portlet_full_SearchWebasturiasWebPortlet_articleId=2536136
Govern Illes Balears (2011-2022). Boletines de sanidad Vegetal. Palma, España: Govern Illes Balears. Recuperado de http://www.caib.es/sites/sanitatvegetal/es/l/boletines_de_sanidad_vegetal-894/?mcont=1531
Hans Braxmeier, H y Steinberger, S. (2017-2019) Pixabay · Maravillosas imágenes gratis. Neu-Ulm, Alemania: Pixabay. Recuperado de https://pixabay.com/es/
Instituto Navarro de Tecnologías e Infraestructuras Agroalimentarias, SA. (2019) Estación de Avisos. Villava (Navarra), España. Recuperado de https://estacionavisos.agrointegra.intiasa.es/ai/accesoVisor.do
Junta de Comunidades de Castilla-La Mancha (2012-2022) Boletines de Avisos Fitosanitarios. Toledo, España: Junta de Comunidades de Castilla-La Mancha. Recuperado de Boletín fitosanitario de avisos. | Gobierno de Castilla-La Mancha (castillalamancha.es)
Junta de Extremadura (2014-2022) Boletín fitosanitario de avisos e informaciones .Mérida, España: Junta de Extremadura. Recuperado de https://www.juntaex.es/temas/agricultura-ganaderia/sanidad-vegetal
Ministerio de Agricultura, Pesca y Alimentación del Gobierno de España (2018-2022). Diagnóstico de plagas y enfermedades. Madrid, España: Ministerio de Agricultura, Pesca y Alimentación. Recuperado de https://www.mapa.gob.es/app/observatorio-de-tecnologias-probadas/diagnostico/consulta.asp
Ministerio de Agricultura, Pesca y Alimentación del Gobierno de España (2018-2022). Registro de Productos Fitosanitarios. Madrid, España: Ministerio de Agricultura, Pesca y Alimentación. Recuperado de https://www.mapa.gob.es/es/agricultura/temas/sanidad-vegetal/productos-fitosanitarios/registro-productos/
NEIKER-Tecnalia, Instituto Vasco de Investigación y Desarrollo Agrario (2006-2022) Avisosneiker. Arkaute, España: Neiker. Recuperado de http://www.avisosneiker.com/
Xunta de Galicia (2017-2022) Meteogalicia. Santiago de Compostela, España: Xunta de Galicia. Recuperado de http://servizos.meteogalicia.es/agroMeteo/index.action;jsessionid=7CD500D86483845AD2AAA0972D8FB06C.EUME-02C?request_locale=es












